উইকিশৈশব:রাসায়নিক মৌল/গঠন
গঠন
[সম্পাদনা]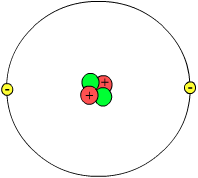
প্রোটন, নিউট্রন এবং ইলেকট্রন মিলে পরমাণু তৈরি করে। এই কারণে, তাদের বলা হয় উপ-পরমাণু কণা। বিভিন্ন ধরনের পরমাণুতে প্রোটন, নিউট্রন এবং ইলেকট্রনের সংখ্যা আলাদা হতে পারে। পরমাণুর বর্তমান ইলেক্ট্রন ক্লাউড তত্ত্ব অনুসারে: পরমাণুর দুটি অংশ আছে, নিউক্লিয়াস এবং ইলেক্ট্রন ক্লাউড। নিউক্লিয়াস প্রোটন এবং নিউট্রন দ্বারা গঠিত, এবং এই নিউক্লিয়নগুলির প্রতিটি "কোয়ার্ক" নামক আরও ছোট কণার তিনগুণ দ্বারা গঠিত।
নিউক্লিয়াস হল পরমাণুর কেন্দ্র এবং এতে প্রোটন এবং নিউট্রন থাকে। ইলেকট্রন ক্লাউডের তুলনায় নিউক্লিয়াস খুবই ছোট। এর মানে হল নিউক্লিয়াসের চারপাশে প্রচুর পরিমাণে ফাঁকা জায়গা। একটি পরমাণুর প্রোটন এবং নিউট্রন নির্দিষ্ট স্থানে থাকে। প্রোটন এবং নিউট্রন উভয়েরই ভর প্রায় ১ এমইউ (পারমাণবিক ভর একক)। তাই একটি পরমাণুর পারমাণবিক ভর হল প্রোটন এবং নিউট্রনের সংখ্যার সমষ্টি। (ইলেক্ট্রন হাজার হাজার গুণ হালকা, তাই তারা গণনার অংশ নয়।)
প্রোটনের ধনাত্মক চার্জ থাকে। প্রোটনের সংখ্যা নির্ধারণ করে সেটি কোন পরমাণু। উদাহরণস্বরূপ, যদি একটি পরমাণুর একটি প্রোটন থাকে, তার মানে এটি একটি হাইড্রোজেন পরমাণু; শুধুমাত্র হাইড্রোজেনে একটি প্রোটন থাকতে পারে। পর্যায় সারণীতে, মৌলের পারমাণবিক সংখ্যা তার প্রোটন সংখ্যার সমান।
নিউট্রনের কোনো চার্জ নেই, তবে তারা নিউক্লিয়াসকে স্থিতিশীল করতে সাহায্য করে; যদি প্রোটনের ধনাত্মক চার্জ নিউক্লিয়াসে থাকে তবে তারা একে অপরকে বিকর্ষণ করবে এবং নিউক্লিয়াস কম স্থিতিশীল হত। একই মৌলের পরমাণু কিন্তু বিভিন্ন সংখ্যক নিউট্রনসহ থাকলে তখন তাদের একে অপরের আইসোটোপ বলে। উদাহরণস্বরূপ, হাইড্রোজেনের তিনটি প্রাকৃতিক আইসোটোপ রয়েছে, একটিতে নিউট্রন নেই, একটিতে একটি নিউট্রন এবং একটিতে দুইটি নিউট্রন রয়েছে। তাদের সকলের একটি প্রোটন আছে এবং তাই তারা সব হাইড্রোজেন, কিন্তু নিউট্রনের সংখ্যার মধ্যে পার্থক্যের কারণে তারা বিভিন্ন আইসোটোপ। কিছু আইসোটোপ তেজস্ক্রিয়, যার মানে হল যে তারা ক্ষয়প্রাপ্ত হয় বা সময়ের সাথে সাথে ক্ষয় হয়। কার্বনের একটি তেজস্ক্রিয় আইসোটোপ, যাকে বলা হয় কার্বন-১৪ (১৪ পারমাণবিক ভরসহ কার্বন) জীবাশ্মের বয়স বের করতে জীবাশ্মবিদরা ব্যবহার করেন। তারা এটি করতে পারেন কারণ তারা জানেন যে কোন হারে কার্বন-১৪ ক্ষয় হয়।
পরমাণুর বাইরের অংশে, ইলেক্ট্রন ক্লাউড, নিউক্লিয়াসকে ঘিরে থাকে। কোয়ান্টাম মেকানিক্স নামে একটি তত্ত্ব অনুসারে, আমরা কখনই নির্দিষ্ট ইলেকট্রনের সঠিক অবস্থান বা গতি জানি না; আমরা শুধুমাত্র এটা কোন জায়গায় হওয়ার সম্ভাবনা তা বলতে পারি। আমরা যদি ইলেকট্রন ঠিক কোথায় তা জানি, কিন্তু আমরা জানি না এটি কত দ্রুত যাচ্ছে। একইভাবে, যদি আমরা জানি যে এটি কত দ্রুত চলছে, আমরা ঠিক কোথায় এটি অবস্থান করছে তা নির্ধারণ করতে পারি না। একটি ইলেক্ট্রনের একটি ঋণাত্মক চার্জ রয়েছে যা প্রোটনের ধনাত্মক চার্জের মতো শক্তিশালী। কিছু বিজ্ঞানী মনে করতেন যে ইলেক্ট্রনগুলো সূর্যের চারপাশে গ্রহের মতো নিউক্লিয়াসকে প্রদক্ষিণ করে, কিন্তু আমরা এখন জানি এটি সত্য নয়। ইলেকট্রনগুলো কিছুটা এলোমেলোভাবে নিউক্লিয়াসের চারপাশে ঘোরাফেরা করে এবং নিউক্লিয়াসে প্রোটনের ধনাত্মক চার্জের প্রতি আকৃষ্ট হয়।
পরমাণু = বিল্ডিং ব্লক
[সম্পাদনা]পরমাণু হল রসায়ন এবং মহাবিশ্বের সবকিছুর ভিত্তি। সকলের মনে রাখা উচিত যে পদার্থ পরমাণু দ্বারা গঠিত। পরমাণু এবং পরমাণুর অধ্যয়ন তাদের নিজেদের কাছে একটি পৃথিবী। আমরা পারমাণবিক গঠন এবং পরমাণুর মধ্যে বন্ধনের মত মৌলিক বিষয়গুলো বর্ণনা করতে যাচ্ছি। আপনি যখন আরও শিখবেন, তখন আপনি প্রাণরসায়ন টিউটোরিয়ালগুলোতে যেতে পারেন এবং দেখতে পারেন কিভাবে পরমাণুগুলো যৌগ গঠন করে যা জৈবিক বিশ্বকে বেঁচে থাকতে সাহায্য করে।
ইলেক্ট্রন বিন্যাস
[সম্পাদনা]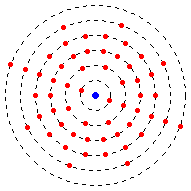
ইলেকট্রনগুলি "শক্তি স্তরে" সংগঠিত থাকে।
| শক্তি স্তর | ইলেকট্রন ধারণক্ষমতা[১] |
|---|---|
| প্রথম | ২ |
| দ্বিতীয় | ৮ |
| তৃতীয় | ১৮ |
| চতুর্থ | ৩২ |
| পঞ্চম | ৫০ |
| ষষ্ঠ | ৭২ |
ইলেকট্রন উচ্চ শক্তি স্তরে থাকার জন্য শক্তির মাত্রা পূর্ণ হতে হবে না। উদাহরণস্বরূপ, টাইটানিয়ামের একটি ইলেক্ট্রন কনফিগারেশন রয়েছে ২-৮-১০-২। অর্থাৎ এটির প্রথম শক্তি স্তরে ২টি, দ্বিতীয়টিতে ৮টি, তৃতীয়টিতে ১০টি এবং চতুর্থটিতে ২টি ইলেকট্রন রয়েছে।
যেমনটি আগে ব্যাখ্যা করা হয়েছে, কিছু পরমাণুতে শুধুমাত্র একটি নির্দিষ্ট পরিমাণ ইলেকট্রন থাকে, তাই কিছু পরমাণুতে অন্য পরমাণুর মতো ইলেক্ট্রনের শক্তির সব স্তর থাকে না।
সবচেয়ে বাইরের শক্তি স্তরকে ভ্যালেন্স শক্তি স্তর বলা হয়। একইভাবে, বাইরের শক্তিস্তরের ইলেকট্রনকে ভ্যালেন্স ইলেকট্রন বলে। এই ইলেকট্রনগুলো পরমাণুগুলোকে অণুতে একত্রিত করতে সহায়তা করে।
